40 Contoh Soal Ujian Sekolah (USP/USBN) Kimia Kelas 12 SMA/MA Kurikulum 2013 Beserta Kunci Jawaban Tahun 2022 / 2023 - Menghadapi Ujian Sekolah/USP mata pelajaran kimia tahun 2023 ini, admin kembali memposting contoh soal-soal USP/USBN yang bisa siswa menengah atas pelajari sebagai referensi belajar online, yang materi soalnya diambil dari tahun-tahun sebelumnya.
Khusus materi soal USP Kimia tahun 2023, soal diambil dari tahun 2020 dengan materi sebanyak 40 butir soal (35 PG + 5 essay/uraian).
Berikut di bawah ini, soal USP/USBN kimia dilengkapi kunci jawaban dengan pertanyaan dimulai dari nomor 1.
1. Perhatikan gambar berikut!
Label kemasan zat kimia tersebut merupakan simbol ....
A. mudah terbakar
B. korosif
C. beracun
D. mudah meledak
E. menyebabkan iritasi
Jawaban: D
2. Perhatikan notasi unsur berikut!
Letak unsur dan konfigurasi elektron yang paling tepat adalah ....
Jawaban: D
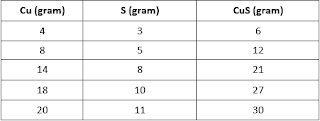
3. Data percobaan reaksi tembaga dan belerang sebagai berikut!
Pada massa tersebut digunakan belerang berlebihan. Berdasarkan data percobaan itu, perbandingan massa tembaga dengan massa belerang adalah ....
A. 1 : 3
B. 2 : 1
C. 2 : 7
D. 4 : 3
E. 7 : 4
Jawaban: B
4. Jika 204 gram bauksit (Mr Al2O3 = 102) direduksi sempurna menghasilkan 54 gram aluminium (Ar Al = 27). Persentase Al2O3 dalam cuplikan tersebut adalah ....
A. 50 %
B. 75 %
C. 80 %
D. 90 %
E. 100 %
Jawaban: A
5. Diketahui nama 5 senyawa sebagai berikut!
1) PCl5 = fosforus pentaklorida
2) As2O3 = arsen oksida
3) Al2O3 = aluminium oksida
4) BaCl2 = barium klorida
5) Ca(OH)2 = kalsium hidroksida
Dari data tersebut, nama yang tidak sesuai dengan kaidah pemberian nama menurut IUPAC adalah ....
A. 1)
B. 2)
C. 3)
D. 4)
E. 5)
Jawaban: B
Baca juga soal-soal USP lainnya:
- Contoh Soal USP Biologi Kelas 12 Kurikulum 2013 Beserta Jawaban
- 40 Contoh Soal USP Matematika Wajib Kelas 12 Beserta Kunci Jawaban
- 90 contoh soal USP PAI SMA/SMK Kurikulum 2013 Beserta Jawaban
- 100+ contoh soal USP PPKn SMA/MA/SMK/MAK Beserta Kunci Jawabannnya
- 40 Contoh Soal USP Bahasa Indonesia SMA/MA/SMK/MAK Kurikulum 2013~Persiapan Ujian Tahun 2022
- Contoh Soal USP Fisika SMA Beserta Jawaban
6. Pernyataan berikut yang bukan tentang teori atom Dalton adalah ....
A. atom adalah bagian terkecil dari materi yang tidak dapat dibagi lagi
B. atom tidak dapat diciptakan dan tidak dapat dimusnahkan
C. atom dari unsur yang berbeda dapat bergabung membentuk senyawa
D. reaksi kimia melibatkan pemisahan atau penggabungan atau penyusunan kembali atom-atom
E. atom digambarkan sebagai roti kismis
Jawaban: E
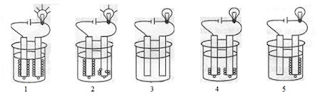
7. Perhatikan gambar pengujian daya hantar beberapa larutan ini!
Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut adalah ....
A. 1 dan 2
B. 1 dan 3
C. 1 dan 5
D. 2 dan 3
E. 4 dan 5
Jawaban: C
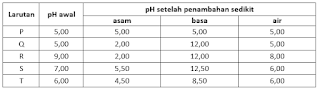
8. Dari percobaan diperoleh data :
Larutan di atas yang merupakan larutan penyangga adalah ....
A. P
B. Q
C. R
D. S
E. T
Jawaban: A
9. Larutan dengan pH 12 dibuat dengan melarutkan a gram NaOH (Mr = 40) ke dalam air hingga volume larutan 500 mL. Besarnya a adalah ....
A. 4,0 gram
B. 2,0 gram
C. 1,0 gram
D. 0,4 gram
E. 0,2 gram
Jawaban: E
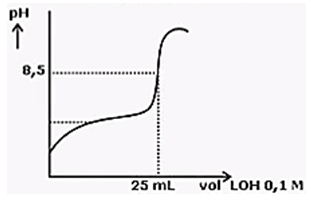
10. Perhatikan grafik titrasi asam-basa berikut!
Jika volume larutan yang dititrasi sebanyak 10 mL konsentrasi larutan asam HX itu adalah ....
A. 0,25 M
B. 0,125 M
C. 0,1 M
D. 0,075 M
E. 0,04 M
Jawaban: A
11. Massa (NH4)2SO4 (Mr = 132) yang harus dilarutkan dalam air sehingga membentuk 100 mL larutan dengan pH = 5 (Kb NH3 = 1 x 10-5) adalah ....
A. 0,33 gram
B. 0,66 gram
C. 1,32 gram
D. 2,64 gram
E. 13,2 gram
Jawaban: B
12. Seorang peneliti mengambil sampel air sungai untuk mengetahui kandungan zat tertentu. Hal pertama yang dilakukan adalah memisahkan pengotor dengan airnya, yaitu menuangkan air ke dalam wadah lain dan memisahkan partikel besarnya, lalu air yang terpisah tadi disaring menggunakan kertas saring, Proses pemisahan campuran yang telah dilakukan adalah ....
A. destilasi dan filtrasi
B. dekantansi dan filtrasi
C. ekstraksi dan dekantansi
D. kromatografi dan destilasi
E. ekstraksi dan kromatografi
Jawaban: B
13. Campuran larutan berikut ini yang dapat membentuk larutan penyangga adalah ....
A. 50 mL CH3COOH 0,2 M dan 50 mL NaOH 0,1 M
B. 50 mL CH3COOH 0,2 M dan 100 mL NaOH 0,1 M
C. 50 mL HCl 0,2 M dan 100 mL NH3 0,1 M
D. 50 mL HCl 0,2 M dan 50 mL NH3 0,1 M
E. 50 mL HCl 0,2 M dan 100 mL NaOH 0,1 M
Jawaban: A
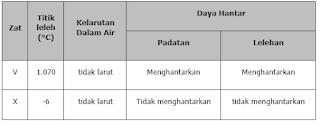
14. Perhatikan data hasil percobaan sebagai berikut!
Jenis ikatan yang terdapat pada zat V dan X secara berturut-turut adalah ....
A. ikatan logam dan ikatan ion
B. ikatan logam dan kovalen polar
C. ikatan kovalen polar dan kovalen non-polar
D. ikatan logam dan kovalen non-polar
E. ikatan ion dan kovalen non-polar
Jawaban: D
15. Prinsip cuci darah bagi penderita gagal ginjal dilakukan berdasarkan ....
A. Efek Tyndall
B. dialisis
C. absorpsi
D. elektroforesis
E. koagulasi
Jawaban: B
16. Berikut ini adalah reaksi kesetimbangan.
4 A(g) + 2 B(g) ⇋ 2 C(g) ∆H = - 60 kJ
Keadaan yang akan menyebabkan kesetimbangan bergeser ke arah kiri (membentuk reaktan lebih banyak) adalah ....
A. menurunkan suhu
B. menambahkan katalis
C. menambahkan konsentrasi A
D. menambahkan volume
E. menaikkan tekanan
Jawaban: D
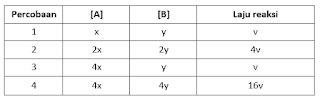
17. Percobaan yang dilakukan untuk mempelajari kinetika kimia dari reaksi:
A + B → P + Q
Dari hasil percobaan tersebut dapat disimpulkan bahwa persamaan laju reaksi yang sesuai adalah ....
A. v = k [A] [B]
B. v = k [A]2 [B]
C. v = k [A] [B]2
D. v = k [B]
E. v = k [B]2
Jawaban: D
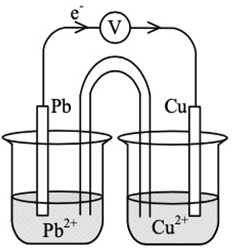
18. Perhatikan gambar berikut!
Reaksi yang terjadi pada anode adalah ....
A. Pb2+ + 2e- → Pb
B. Pb → Pb2+ + 2e-
C. Cu2+ + 2e- → Cu
D. Cu → Cu2+ + 2e-
E. Pb2+ + Cu → Pb + Cu2+
Jawaban: B
19. Perhatikan persamaan reaksi redoks berikut!
Sn(s) + 4HNO3(aq) → SnO
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ....
A. +1, Sn
B. +1, SnO2
C. +4, NO2
D. +5, NO2
E. +5, HNO2
Jawaban: D
20. Suatu zat non elektrolit, Mr = 60, sebanyak 3 gram dilarutkan ke dalam 500 gram air, ternyata membeku pada suhu -1 oC. Massa zat tersebut yang harus dilarutkan ke dalam 1500 gram air agar diperoleh larutan yang mempunyai penurunan titik beku 1/4 nya dari penurunan titik beku larutan di atas adalah …
A. 1,25 gram
B. 2,25 gram
C. 3,50 gram
D. 36,00 gram
E. 37,50 gram
Lanjut ke soal nomor 21-40 ==> 40 contoh soal USP Kimia SMA/MA



0 komentar
Posting Komentar